Microorganismos del suelo y sus usos potenciales en la agricultura frente al escenario del cambio climático
DOI:
https://doi.org/10.54502/msuceva.v1n1a14Palabras clave:
Agroecosistemas, Biorremediación, Cambio climático, Consorcio microbiano, Microorganismos del suelo, Potencial biotecnológico, Sistema edáficoResumen
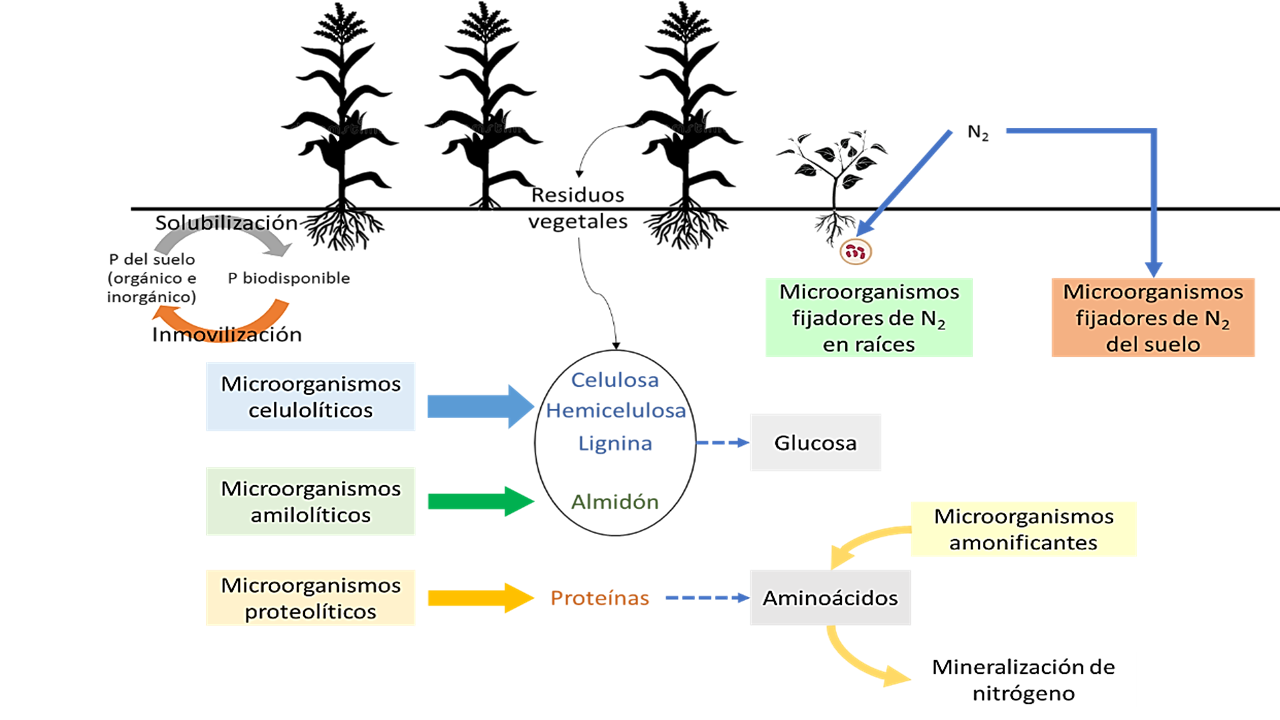
El objetivo de la presente revisión es indagar sobre las interacciones biológicas de los microorganismos del suelo y su potencial biotecnológico en los sistemas agrícolas frente al panorama actual del cambio climático. En este sentido, se hace urgente la búsqueda de estrategias que permitan obtener sistemas productivos sostenibles y resilientes. En virtud de ello, el uso de microorganismos benéficos, constituye una estrategia para el desarrollo de sistemas agrícolas más sostenibles y reducir el impacto negativo de productos químicos y fertilizantes. Investigaciones sobre consorcios microbianos, han permitido estudiar los mecanismos que emplean los microorganismos para establecerse y permanecer en el sistema suelo. Los microorganismos del suelo no actúan de manera aislada, se dinamizan mediante múltiples interacciones, las cuales, contribuyen al buen funcionamiento y equilibrio ecológico del sistema edáfico. Las diferentes funciones que realizan los microorganismos en los sistemas agrícolas, están influenciadas por factores bióticos y abióticos; para lo cual, han desarrollado una capacidad de adaptación admirable y útil para el diseño de estrategias que permitan mitigar los efectos negativos del cambio climático. La inoculación con microorganismos, mejora la disponibilidad de nutrientes para las plantas; contribuye al aprovechamiento de una fuente de nutrientes renovables e incrementan la disponibilidad de nutrientes poco móviles en el suelo, como lo es el fósforo (P).
Descargas
Métricas
Citas
Abakumov EV, Cajthaml T, Brus J, Frouz J. Humus accumulation, humification, and humic acid composition in soils of two post-mining chronosequences after coal mining. Journal of Soils and Sediments 2013; 13:39–59. https://doi.org/10.1007/s11368-012-0579-9.
Abril A. ¿Son los microorganismos edáficos buenos indicadores de impacto productivo en los ecosistemas? Ecología Austral 2003; 13:195–204. http://ojs.ecologiaaustral.com.ar/index.php/Ecologia_Austral/article/view/1532/866
Julca-Otiniano A, Meneses-Florián L, Blas-Sevillano R, Bello-Amez S. La materia orgánica, importancia y experiencia de su uso en la agricultura. Idesia (Arica) 2006; 24:49–61. https://doi.org/10.4067/S0718-34292006000100009.
Montatixe Sánchez CI, Eche Enriquez MD. Degradación del suelo y desarrollo económico en la agricultura familiar de la parroquia Emilio María Terán, Píllaro. Siembra 2021;8: e1735. https://doi.org/10.29166/siembra.v8i1.1735.
Chaparro JM, Sheflin AM, Manter DK, Vivanco JM. Manipulating the soil microbiome to increase soil health and plant fertility. Biology and Fertility of Soils 2012; 48:597–604. https://doi.org/10.1007/s00374-012-0691-4.
Herrera A, Castellanos F. Análisis metagenómico de la microbiota edáfica de la reserva de la biósfera de Calakmul. Revista Electrónica Ide@s Del Consejo de Ciencia y Tecnología Del Estado de Guanajuato 2007; 29:802–23.
Campo Martinez A, Acosta Sanchez R, Morales Velasco S, Prado F. Evaluación de microorganismos de montaña (mm) en la producción de acelga en la meseta de Popayán. Biotecnología En El Sector Agropecuario y Agroindustrial 2014; 12:79–87. https://revistas.unicauca.edu.co/index.php/biotecnologia/article/view/322
Gamboa-Angulo JJ, Ruíz-Sánchez E, Alvarado-López CJ, Gutiérrez-Miceli F, Ruíz-Valdiviezo VM, Medina-Dzul KB. Efecto de biofertilizantes microbianos en las características agronómicas de la planta y calidad del fruto del chile xcat´ik (Capsicum annuum L.). Revista Terra Latinoamericana 2020; 38:817–26. https://doi.org/10.28940/terra.v38i4.716.
Gutiérrez-Sarmiento W, Sáyago-Ayerdi SG, Goñi I, Gutiérrez-Miceli FA, Abud-Archila M, Rejón-Orantes J del C, et al.Changes in Intestinal Microbiota and Predicted Metabolic Pathways During Colonic Fermentation of Mango (Mangifera indica L.)—Based Bar Indigestible Fraction. Nutrients 2020; 12:1–18. https://doi.org/10.3390/nu12030683.
Tanya Morocho M, Leiva Mora M. Microorganismos eficientes, propiedades funcionales y aplicaciones agrícolas. Centro Agrícola 2019; 46:93–103. http://scielo.sld.cu/pdf/cag/v46n2/0253-5785-cag-46-02-93.pdf
Ney L, Franklin D, Mahmud K, Cabrera M, Hancock D, Habteselassie M, et al. Impact of inoculation with local effective microorganisms on soil nitrogen cycling and legume productivity using composted broiler litter. Applied Soil Ecology 2020; 154:1–8. https://doi.org/10.1016/j.apsoil.2020.103567.
Rosatto Moda L, de Mello Prado R, Castellanos Gonzáles L, Reyes Hernández A, Caione G, Silva Campos C. Solubilización de fuentes de fósforo asociadas a un compuesto orgánico enriquecido con biofertilizantes. Agrociencia 2014; 48:489–500. http://www.scielo.org.mx/pdf/agro/v48n5/v48n5a3.pdf
Montejo-Martínez M, Torres-López A, Martínez-Toledo J, Tenorio-López M, Cruz-Colín F, Ramos-Morales R, et al. Técnicas para el análisis de actividad enzimática en suelos. In: Cuevas-Díaz M, Espinosa-Reyes G, Ilizaliturri-Hernández C, Mendoza-Cantú A, editors. Métodos ecotoxicológicos para la evaluación de suelos contaminados con hidrocarburos. 1st ed., México, D.F.: Instituto Nacional de Ecología (INESemarnat); 2012, p. 16–46.
Bailón-Rojas MR, Florida-Rofner N. Caracterización y calidad de los compost producidos y comercializados en Rupa Rupa-Huánuco. Enfoque UTE 2021; 12:1–11. https://doi.org/10.29019/enfoqueute.644.
Paolini Gómez JE. Actividad microbiológica y biomasa microbiana en suelos cafetaleros de los Andes venezolanos. Revista Terra Latinoamericana 2018; 36:13–22. https://doi.org/10.28940/terra.v36i1.257.
Pascual-Córdova G, Obrador-Olán J, Carrillo-Ávila E, García-López E, Sánchez-Soto S, Guerrero-Peña A, et al. Indicadores de calidad del suelo en el agroecosistema caña de azúcar (Saccharum spp.). Revista De La Facultad De Agronomía De La Universidad Del Zulia 2017; 35:1–25. https://produccioncientificaluz.org/index.php/agronomia/article/view/27258
Reyes I, Valery A. Efecto de la fertilidad del suelo sobre la microbiota y la promoción del crecimiento Del maíz (Zea mays L.) Con Azotobacter spp. BioAgro 2007; 19:117–26.
de los Santos Villalobos S, Parra Cota FI, Herrera Sepúlveda A, Valenzuela Aragón B, Estrada Mora JC. Colmena: colección de microorganismos edáficos y endófitos nativos, para contribuir a la seguridad alimentaria nacional. Revista Mexicana de Ciencias Agrícolas 2018; 9:191–202. https://doi.org/10.29312/remexca.v9i1.858.
Nogales B. La microbiología del suelo en la era de la biología molecular: descubriendo la punta del iceberg. Ecosistemas 2005; 14:41–50. https://www.revistaecosistemas.net/index.php/ecosistemas/article/view/153
Lyautey E, Lacoste B, Ten-Hage L, Rols J-L, Garabetian F. Analysis of bacterial diversity in river biofilms using 16S rDNA PCR-DGGE: methodological settings and fingerprints interpretation. Water Research 2005; 39:380–8. https://doi.org/10.1016/j.watres.2004.09.025.
Guerrero R, Berlanga M. Microbios en la niebla: descubriendo el papel de los microbios en la biosfera. Ecosistemas 2005; 14:3–10. https://www.revistaecosistemas.net/index.php/ecosistemas/article/view/149
Abril A. ¿Son los microorganismos edáficos buenos indicadores de impacto productivo en los ecosistemas? Ecología Austral 2003;13:195–204. http://ojs.ecologiaaustral.com.ar/index.php/Ecologia_Austral/article/view/1532/866
Wang K, Peng C, Zhu Q, Zhou X, Wang M, Zhang K, et al. Modeling global soil carbon and soil microbial carbon by integrating microbial processes into the ecosystem process model TRIPLEX-GHG. Journal of Advances in Modeling Earth Systems 2017;9:2368–84. https://doi.org/10.1002/2017MS000920.
Syakila A, Kroeze C. The global nitrous oxide budget revisited. Greenhouse Gas Measurement and Management 2011;1:17–26. https://doi.org/10.3763/ghgmm.2010.0007.
Hayden HL, Mele PM, Bougoure DS, Allan CY, Norng S, Piceno YM, et al. Changes in the microbial community structure of bacteria, archaea and fungi in response to elevated CO2 and warming in an Australian native grassland soil. Environmental Microbiology 2012;14:3081–96. https://doi.org/10.1111/j.1462-2920.2012.02855.x.
Dunbar J, Eichorst SA, Gallegos-Graves LV, Silva S, Xie G, Hengartner NW, et al. Common bacterial responses in six ecosystems exposed to 10 years of elevated atmospheric carbon dioxide. Environmental Microbiology 2012;14:1145–58. https://doi.org/10.1111/j.1462-2920.2011.02695.x.
Schimel J, Balser TC, Wallenstein M. Microbial stress response physiology and its implications for ecosystem function. Ecology 2007;88:1386–94. https://doi.org/10.1890/06-0219.
Jansson JK, Hofmockel KS. Soil microbiomes and climate change. Nature Reviews Microbiology 2020; 18:35–46. https://doi.org/10.1038/s41579-019-0265-7.
Pedraza R, Teixeira K-RS, Scavino AF, de Salamone IG, Baca B, Azcón R, et al. Microorganismos que mejoran el crecimiento de las plantas y la calidad de los suelos. Revisión. Ciencia & Tecnología Agropecuaria 2010; 11:155–64. https://doi.org/10.21930/rcta.vol11_num2_art:206.
Julca-Otiniano A, Meneses-Florián L, Blas-Sevillano R, Bello-Amez S. La materia orgánica, importancia y experiencia de su uso en la agricultura. Idesia (Arica) 2006; 24:49–61. https://doi.org/10.4067/S0718-34292006000100009.
Olalde V, Aguilera L. Microorganismos y biodiversidad. Terra Latinoamericana 1998; 16:289–92. https://www.redalyc.org/pdf/573/Resumenes/Resumen_57316312_1.pdf
Calvo Vélez P, Reymundo Meneses L, Zúñiga Dávila D. Estudio de las poblaciones microbianas de la rizósfera del cultivo de papa (Solanum tuberosum) en zonas altoandinas. Ecología Aplicada 2008; 7:141–8. https://doi.org/10.21704/rea.v7i1-2.369.
Aly SM, Abdel-Galil Ahmed Y, Abdel-Aziz Ghareeb A, Mohamed MF. Studies on Bacillus subtilis and Lactobacillus acidophilus, as potential probiotics, on the immune response and resistance of Tilapia nilotica (Oreochromis niloticus) to challenge infections. Fish & Shellfish Immunology 2008;25:128–36. https://doi.org/10.1016/j.fsi.2008.03.013.
Beltrán Pineda ME. La solubilización de fosfatos como estrategia microbiana para promover el crecimiento vegetal. Ciencia & Tecnología Agropecuaria 2015; 15:101–13. https://doi.org/10.21930/rcta.vol15_num1_art:401.
Bashan Y, Puente E, Salazar B, De-Bashan L, Bacilio M, Hernández J, et al. Reforestación de tierras erosionadas en el desierto: el papel de las bacterias promotoras de crecimiento en plantas y la materia orgánica. Suelos Ecuatorianos 2015; 35:70–7. http://bashanfoundation.org/gmaweb/pdfs/suelosecuatoriales.pdf
Rodríguez Z, Boucurt R, Rodríguiez J, Albelo N, Nuñez O, Herrera F. Aislamiento y selección de microorganismos con capacidad de degradar el almidón. Revista Cubana de Ciencia Agrícola 2006; 40:349–54. https://www.redalyc.org/pdf/1930/193017723014.pdf
Matsumoto LS, Martines AM, Avanzi MA, Albino UB, Brasil CB, Saridakis DP, et al. Interactions among functional groups in the cycling of, carbon, nitrogen and phosphorus in the rhizosphere of three successional species of tropical woody trees. Applied Soil Ecology 2005;28:57–65. https://doi.org/10.1016/J.APSOIL.2004.06.008.
Cao C, Jiang D, Teng X, Jiang Y, Liang W, Cui Z. Soil chemical and microbiological properties along a chronosequence of Caragana microphylla Lam. plantations in the Horqin sandy land of Northeast China. Applied Soil Ecology 2008;40:78–85. https://doi.org/10.1016/J.APSOIL.2008.03.008.
Bertola M, Ferrarini A, Visioli G. Improvement of soil microbial diversity through sustainable agricultural practices and its evaluation by Omics approaches: A perspective for the environment, food quality and human safety. Microorganisms 2021;9:1–22. https://doi.org/10.3390/microorganisms9071400.
Helgason BL, Gregorich EG, Janzen HH, Ellert BH, Lorenz N, Dick RP. Long-term microbial retention of residue C is site-specific and depends on residue placement. Soil Biology and Biochemistry 2014;68:231–40. https://doi.org/10.1016/J.SOILBIO.2013.10.002.
López-Mondéjar R, Zühlke D, Becher D, Riedel K, Baldrian P. Cellulose and hemicellulose decomposition by forest soil bacteria proceeds by the action of structurally variable enzymatic systems. Scientific Reports 2016; 6:6:25279. https://doi.org/10.1038/srep25279.
Beltrán Pineda ME, Rocha Gil ZE, Bernal Figueroa AA, Pita Morales LA. Microorganismos funcionales en suelos con y sin revegetalización en el municipio de Villa de Leyva, Boyacá. Colombia Forestal 2017; 20:159–70. https://doi.org/10.14483/udistrital.jour.colomb.for.2017.2.a05.
Beltrán Pineda M, Lizarazo Forero L. Grupos funcionales de microorganismos en suelos de páramo afectados por incendios forestales. Revista de Ciencias 2013; 17:121–36. https://core.ac.uk/download/pdf/267165574.pdf
Tamariz-Angeles C. Isolation and identification of cellulolytic and xylanolytic bacteria from Huancarhuaz Hot Spring, Peru. Annual Research & Review in Biology 2014;4:2920–30. https://doi.org/10.9734/ARRB/2014/10699.
Montor-Antonio J, Olvera-Carranza C, Reyes-Duarte D, Sachman-Ruiz B, Ramírez-Coutiño L, del Moral S. Caracterización bioquímica de AmiJ33, una amilasa de Bacillus amyloliquefaciens aislada de suelos cultivados con caña de azúcar en la región del Papaloapan. Nova Scientia 2014;6. http://www.scielo.org.mx/pdf/ns/v6n12/v6n12a3.pdf
Zimmermann M, Leifeld J, Fuhrer J. Quantifying soil organic carbon fractions by infrared-spectroscopy. Soil Biology and Biochemistry 2007; 39:224–31. https://doi.org/10.1016/j.soilbio.2006.07.010.
Álvarez-López C, Osorio-Vega W, Díez-Gómez MC, Marín-Montoya M. Caracterización bioquímica de microorganismos rizosféricos de plantas de vainilla con potencial como biofertilizantes. Agronomía Mesoamericana 2014. https://doi.org/10.15517/am.v25i2.15426.
Pyke DA, Archer S. Plant-Plant Interactions Affecting Plant Establishment and Persistence on Revegetated Rangeland. Journal of Range Management 1991;44. https://doi.org/10.2307/4003035.
Compant S, van der Heijden MGA, Sessitsch A. Climate change effects on beneficial plant-microorganism interactions. FEMS Microbiology Ecology 2010;73:197–214. https://doi.org/10.1111/j.1574-6941.2010.00900.x.
Hu A, Chen X, Luo S, Zou Q, Xie J, He D, et al. Rhizobium leguminosarum glutathione peroxidase is essential for oxidative stress resistance and efficient nodulation. Frontiers in Microbiology 2021;12:627562. https://doi.org/10.3389/fmicb.2021.627562.
Alori ET, Glick BR, Babalola OO. Microbial phosphorus solubilization and its potential for use in sustainable agriculture. Frontiers in Microbiology 2017; 8:971. https://doi.org/10.3389/fmicb.2017.00971.
Vargas Barrantes P, Castro Barquero L. Aislamiento y evaluación de microorganismos solubilizadores de fósforo de Andisoles de Costa Rica. Agronomía Costarricense 2018; 43:47–68. https://doi.org/10.15517/rac.v43i1.35649.
Tapia-Torres Y, García-Oliva F. La disponibilidad del fósforo es producto de la actividad bacteriana en el suelo en ecosistemas oligotróficos: Una revisión crítica. Terra Latinoamericana 2013; 31:231–42. http://www.scielo.org.mx/pdf/tl/v31n3/2395-8030-tl-31-03-00231.pdf
Patiño-Torres C, Sanclemente-Reyes O. Los microorganismos solubilizadores de fósforo (MSF): una alternativa biotecnológica para una agricultura sostenible. Entramado 2014; 10:288–97. http://www.scielo.org.co/pdf/entra/v10n2/v10n2a18.pdf
Chuan O, Muhammad I, Chuen Y, Kamaruzzaman Y, Bidai J. Metals contamination using Polymesoda expansa (Marsh Clam) as bio-indicator in Kelatan river, Malaysia. Malaysian Journal of Analytical Science 2017;21:597–604. https://doi.org/10.17576/mjas-2017-2103-09.
Guo JH, Liu XJ, Zhang Y, Shen JL, Han WX, Zhang WF, et al. Significant acidification in major chinese croplands. Science 2010;327:1008–10. https://doi.org/10.1126/science.1182570.
Plante AF. Soil biogeochemical cycling of inorganic nutrients and metals. Academic Press; 2007. https://doi.org/10.1016/B978-0-08-047514-1.50019-6.
Hernández-Flores L, Munive-Hernández J, Sandoval-Castro E, Martínez-Carrera D, Villegas-Hernández M. Efecto de las prácticas agrícolas sobre las poblaciones bacterianas del suelo en sistemas de cultivo en Chihuahua, México. Rev Mex Cienc Agríc 2013; 4:353–65. http://www.scielo.org.mx/pdf/remexca/v4n3/v4n3a2.pdf
Kumar A, Verma JP. Does plant—microbe interaction confer stress tolerance in plants: A review? Microbiological Research 2018;207:41–52. https://doi.org/10.1016/j.micres.2017.11.004.
Grageda-Cabrera O, Díaz-Franco A, Peña-Cabriales J, Vera-Nuñez J. Impacto de los biofertilizantes en la agricultura. Rev Mex Cienc Agríc 2012; 3:1261–74. http://www.scielo.org.mx/pdf/remexca/v3n6/v3n6a15.pdf
Restrepo Correa SP. Mecanismos de acción de hongos y bacterias empleados como biofertilizantes en suelos agrícolas: una revisión sistemática. Corpoica Ciencia y Tecnología Agropecuaria 2017; 18:335–51. https://doi.org/10.21930/rcta
Vitorino LC, Bessa LA. Technological microbiology: Development and applications. Frontiers in Microbiology 2017; 8:827. https://doi.org/10.3389/fmicb.2017.00827.
Creus C. Inoculantes microbianos: piezas de un rompecabezas que aún requiere ser ensamblado. Revista Argentina de Microbiología 2017; 49:207–9. https://doi.org/10.1016/j.ram.2017.07.001
Salar RK, Purewal SS, Sandhu KS. Bioactive profile, free radical scavenging potential, DNA damage protection activity, and mycochemicals in Aspergillus awamori (MTCC 548) extracts: a novel report on filamentous fungi. 3 Biotech 2017; 7:164. https://doi.org/10.1007/s13205-017-0834-2.
Díaz Borrego L, Marín Leal J, Alburgue Díaz D, Carrasquero Ferrer S, Morales Avendaño E. Consorcio microbiano autóctono para el tratamiento de aguas contaminadas con gasoil del puerto de Isla de Toas (Venezuela). Ciencia e Ingeniería Neogranadina 2018; 28:5–27. https://doi.org/https://doi.org/10.18359/rcin.2792.
Ochoa Carreño DC, Montoya Restrepo A. Consorcios microbianos: una metáfora biológica aplicada a la asociatividad empresarial en cadenas productivas agropecuarias. Revista Facultad de Ciencias Económicas 2010; 18:55–74. https://doi.org/10.18359/rfce.2272.
Gadd GM. Metals, minerals and microbes: geomicrobiology and bioremediation. Microbiology 2010;156:609–43. https://doi.org/10.1099/mic.0.037143-0.
Northup E, Kathleen H, Lavoie D. Geomicrobiology of Caves: A Review. Geomicrobiology Journal 2001;18:199–222. https://doi.org/10.1080/01490450152467750.
Brenner K, You L, Arnold FH. Engineering microbial consortia: a new frontier in synthetic biology. Trends in Biotechnology 2008;26:483–9. https://doi.org/10.1016/j.tibtech.2008.05.004.
Maier R, Pepper I, Gerba C. Environmental Microbiology. 2nd ed. Elsevier; 2009. https://doi.org/10.1016/B978-0-12-370519-8.X0001-6.
Rivera Cruz M, Trujillo Narcia A, Cordova Ballona G, Kohler J, Caravaca F, Roldan A. Poultry manure and banana waste are effective biofertilizer carriers for promoting plant growth and soil sustainability in banana crops. Soil Biology and Biochemistry 2008;40:3092–5. https://doi.org/10.1016/j.soilbio.2008.09.003.
ben Rebah F. Wastewater sludge as a substrate for growth and carrier for rhizobia: the effect of storage conditions on survival of Sinorhizobium meliloti. Bioresource Technology 2002;83:45–51. https://doi.org/10.1016/S0960-8524(01)00202-4.
Stephens JHG, Rask HM. Inoculant production and formulation. Field Crops Research 2000;65:249–58. https://doi.org/10.1016/S0378-4290(99)00090-8.
Basu S, Rabara R, Negi S. Towards a better greener future - an alternative strategy using biofertilizers. I: Plant growth promoting bacteria. Plant Gene 2017;12:43–9. https://doi.org/10.1016/J.PLGENE.2017.07.004.
González F. H, Fuentes M. N. Mecanismo de acción de cinco microorganismos promotores de crecimiento vegetal. Revista de Ciencias Agrícolas 2017; 34:17–31. https://doi.org/10.22267/rcia.173401.60.
Jha CK, Saraf M. Evaluation of multispecies plant-growth promoting consortia for the growth promotion of Jatropha curcas L. Journal of Plant Growth Regulation 2012;31:588–98. https://doi.org/10.1007/s00344-012-9269-5.
Domenech J, Reddy MS, Kloepper JW, Ramos B, Gutierrez-Mañero J. Combined application of the biological product LS213 with Bacillus, Pseudomonas or Chryseobacterium for growth promotion and biological control of soil-borne diseases in pepper and tomato. Biocontrol 2006; 51:245–58. https://doi.org/10.1007/s10526-005-2940-z.
Chung S. Powder formulation using heat resistant endospores of two multi-functional plant growth promoting rhizobacteria Bacillus strains having Phytophtora blight suppression and growth promoting functions. Journal of the Korean Society for Applied Biological Chemistry 2010;53:485–92. https://doi.org/10.3839/jksabc.2010.074.
Adam M, Heuer H, Hallmann J. Bacterial antagonists of fungal pathogens also control root-knot nematodes by induced systemic resistance of tomato plants. PLoS ONE 2014; 9:1–9. https://doi.org/10.1371/journal.pone.0090402.
Ferraz HGM, Resende RS, Moreira PC, Silveira PR, Milagres EA, Oliveira JR, et al. Antagonistic rhizobacteria and jasmonic acid induce resistance against tomato bacterial spot. Bragantia 2015;74:417–27. https://doi.org/10.1590/1678-4499.0074.
Khavazi K, Akhyani A, Baybordi A, Darya S, Abdolhamid A. Isolation and characterization of plant growth promoting fluorescent pseudomonads and their influence on yield of potato. Rome, Italy: 2007. https://doi.org/10.1007/s11274-017-2369-4
Megali L, Glauser G, Rasmann S. Fertilization with beneficial microorganisms decreases tomato defenses against insect pests. Agronomy for Sustainable Development 2014; 34:649–56. https://doi.org/10.1007/s13593-013-0187-0.
Suchini Ramírez J. Innovaciones agroecológicas para una producción agropecuaria sostenible en la región del Trifinio. Cartago, Turrialba-Costa Rica: 2012. http://orton.catie.ac.cr/repdoc/A10933e/A10933e.pdf
Alarcon J, Recharte D, Yanqui F, Moreno S, Buendía M. Fertilizing with native efficient microorganisms has a positive effect on the phenology, biomass and production of tomato (Lycopersicum esculentum Mill). Scientia Agropecuaria 2020;11:67–73. https://doi.org/10.17268/sci.agropecu.2020.01.08.
National Academies of Sciences Engineering and Medicine. Science breakthroughs to advance food and agricultural research by 2030. Washington, D.C.: National Academies Press; 2019. https://doi.org/10.17226/25059.
Itakura M, Uchida Y, Akiyama H, Hoshino YT, Shimomura Y, Morimoto S, et al. Mitigation of nitrous oxide emissions from soils by Bradyrhizobium japonicum inoculation. Nature Climate Change 2013;3:208–12. https://doi.org/10.1038/nclimate1734.
Naylor D, Coleman-Derr D. Drought stress and root associated bacterial communities. Frontiers in Plant Science 2018;8:2223. https://doi.org/10.3389/fpls.2017.02223.
Hu A, Chen X, Luo S, Zou Q, Xie J, He D, et al. Rhizobium leguminosarum glutathione peroxidase is essential for oxidative stress resistance and efficient nodulation. Frontiers in Microbiology 2021;12:627562. https://doi.org/10.3389/fmicb.2021.627562.
Lakshmanan V, Ray P, Craven KD. Toward a resilient, functional microbiome: Drought tolerance-alleviating microbes for sustainable agriculture. Methods Mol Biol 2017;1631:69–84. https://doi.org/10.1007/978-1-4939-7136-7_4.
Vurukonda SSKP, Vardharajula S, Shrivastava M, SkZ A. Enhancement of drought stress tolerance in crops by plant growth promoting rhizobacteria. Microbiological Research 2016;184:13–24. https://doi.org/10.1016/j.micres.2015.12.003.
Muñoz R, Alvarez MT, Muñoz A, Terrazas E, Guieysse B, Mattiasson B. Sequential removal of heavy metals ions and organic pollutants using an algal-bacterial consortium. Chemosphere 2006;63:903–11. https://doi.org/10.1016/j.chemosphere.2005.09.062.
Hena S, Fatimah S, Tabassum S. Cultivation of algae consortium in a dairy farm wastewater for biodiesel production. Water Resources and Industry 2015;10:1–14.w https://doi.org/10.1016/j.wri.2015.02.002.
Gajda I, Greenman J, Melhuish C, Ieropoulos I. Self-sustainable electricity production from algae grown in a microbial fuel cell system. Biomass and Bioenergy 2015;82:1–7. https://doi.org/10.1016/j.biombioe.2015.05.017.
Vasseur C, Bougaran G, Garnier M, Hamelin J, Leboulanger C, Chevanton M le, et al. Carbon conversion efficiency and population dynamics of a marine algae–bacteria consortium growing on simplified synthetic digestate: First step in a bioprocess coupling algal production and anaerobic digestion. Bioresource Technology 2012;119:79–87. https://doi.org/10.1016/j.biortech.2012.05.128.
Höffner K, Barton PI. Design of Microbial Consortia for Industrial Biotechnology. Computer Aided Chemical Engineering 2014;34:65–74. https://doi.org/10.1016/B978-0-444-63433-7.50008-0.
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2021 Magna Scientia UCEVA

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Magna Scientia UCEVA proporciona un acceso abierto, libre y gratuito a su contenido, basado en el principio de que ofrecer al público un acceso libre a las investigaciones, ayuda a un mayor intercambio global del conocimiento. Lo cual, implica que los usuarios pueden leer, descargar, almacenar, imprimir, buscar, indexar y realizar enlaces a los textos completos de esta revista. Se permite distribuir los diversos artículos en las versiones post-print y oficial, sin previo permiso del autor o editor, considerando que el fin de este, no implica fines comerciales, ni la generación de obras derivadas; Solo se solicita la mención de la fuente así como la autoría. El titular del copyright será el o los autores que publiquen en Magna Scientia UCEVA.
Magna Scientia UCEVA está distribuida bajo los términos de la licencia https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es